| 気液平衡とは | |||||||||||||||||||||||
| 気液平衡の考え方については、高校生にも分かるように、気液平衡の専門家の立場から、解説します。 気液平衡を、蒸気圧から説き起こして解説します。計算方法については高校生のレベルを超えている部分もありますが、チャレンジしては如何でしょうか? | |||||||||||||||||||||||
| 1.蒸気圧とは 2.気液平衡とは 計算例 3.気液平衡の計算方法 気液平衡の計算(1) 平衡係数(平衡比) 気液平衡の計算(2) 相対揮発度 気液平衡の計算(3) ラウールの法則 気液平衡の計算(4) 活量係数 気液平衡の計算(5) 状態方程式 |
|||||||||||||||||||||||
| 1.蒸気圧とは | |||||||||||||||||||||||
|
気液平衡とは混合液(溶液)の蒸気圧のことです。 液体の蒸気圧や塩の溶解度は、「相平衡」と言います。相平衡とは、気体、液体、固体が2つ以上存在しているときのことをいいます。平衡とはつり合っているということです。そういう意味で、蒸気圧とは気体と液体の温度と圧力がつり合っていること、すなわち同じであることから「相平衡」といえます。 気体と液体が平衡であるという意味で、蒸気圧も気液平衡であるといえますが、専門分野で蒸気圧のことは気液平衡とは言いません。飽和蒸気圧という語もありますが、蒸気圧は、もともと飽和状態のことを示していますから、飽和蒸気圧という語もほとんど使われません。 この点が、蒸気圧や気液平衡を初めて学習する高校生には分かりにくい点と言えます。ちなみに、昭和47年発行の教科書「新訂化学B」、東京書籍株式会社発行には、気液平衡という語は記載されていませんでした。 そこで、先ず「蒸気圧とは何か?」について考えます。この答を我々は身近に体験できます。ビーカーに 水を入れて放置しておくと、ビーカーの中の水は無くなります。これは、 水が空気中に蒸発したからです。では、なぜ、水は蒸発するのでしょうか? それは、液体である水の分子が運動しているからです。 |
|||||||||||||||||||||||
|
|||||||||||||||||||||||
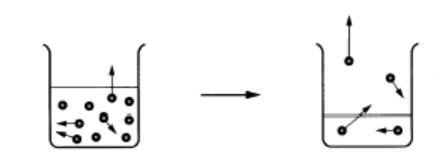
| 図1 水を入れておくと蒸発して空になる | |||||||||||||||||||||||
 |
|||||||||||||||||||||||
| 図2 水の分子が運動して蒸発する |
|||||||||||||||||||||||
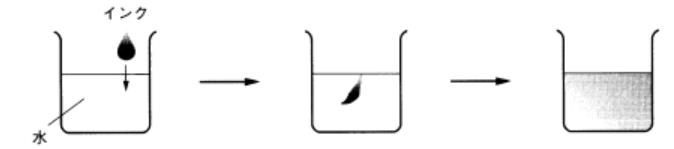
| 水の分子が運動するのは、目で確かめることができます。水の中にインクをたらすと、最初はインクの色が見えますが、しばらくすると、色がうすくなります。一滴程度の場合は、ほとんど色が消えます。これは、 水の分子が運動していて、インクの粒子をちらばすからです。 | |||||||||||||||||||||||
 |
|||||||||||||||||||||||
 |
|||||||||||||||||||||||
|
図3 水にインクをたらすと色がうすくなるのは 水の分子がインクをちらばすから |
|||||||||||||||||||||||
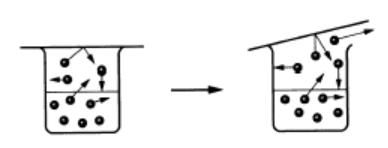
| ビーカーにフタをするとどうなるでしょうか? 水は蒸発して空間に飛び出しては来るものの、行き場がなくて空間で飛び回っています。 このとき、水の分子がフタやビーカーや水面に当ります。水の分子は目には見えませんが、大きくすれば、野球のボールのようなものです。これが、フタやビーカーや水面に当ると、フタを押します。室温程度の温度では、押す力は 弱いのですが、100℃ 以上に加熱すると沸騰してフタを押し上げる程の力となります。この押し上げる力が水の蒸気圧力です。これを水の「蒸気圧」と言います。 |
|||||||||||||||||||||||
 |
|||||||||||||||||||||||
|
図4 水の分子がフタに当り圧力となる →「蒸気圧」 |
|||||||||||||||||||||||
| 2.気液平衡とは | |||||||||||||||||||||||
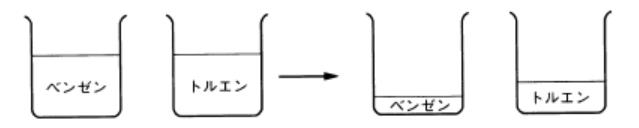
| ところで、水以外の物質でも液体は蒸気圧を発生しています。例えば ベンゼンとトルエンを考えて見ましょう。ベンゼンとトルエンを別々の ビーカーに入れて放置しますと、両方とも蒸発します。しかし、ベンゼン を入れたビーカーの方が先に空になります。 |
|||||||||||||||||||||||
 |
|||||||||||||||||||||||
|
図5 ベンゼンの方が先に蒸発する |
|||||||||||||||||||||||
|
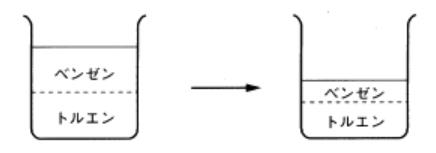
その理由はベンゼンの方がトルエンより蒸気圧が大きいからです。ベンゼンの方が、分子の運動が激しいのです。そのために、トルエンより 余計に蒸発します。すなわち、ベンゼンとトルエンの蒸気圧には差があるのです。 ベンゼンとトルエンを混ぜたらどうなるでしょうか?すなわち、気液平衡とは何かを考えます。 混ぜた場合でもベンゼンの方が余計に蒸発します。混ぜてもベンゼンの蒸気圧の方が大きいことに変わりはないのです。 |
|||||||||||||||||||||||
 |
|||||||||||||||||||||||
| 図6 ベンゼンとトルエンの混合物でも ベンゼンが多く蒸発する |
|||||||||||||||||||||||
|
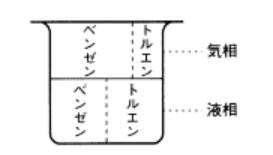
ビーカーにフタをしますと、蒸発したベンゼンやトルエンには逃げ場はありません。ビーカーの中に止まります。その結果、気体はベンゼンの濃いものとなります。図7を見て下さい。液体と気体のベンゼンとトルエンの濃度を示しました。液体中にはベンゼンとトルエンが同じ量入っているものとします。気体(蒸気)になると、ベンゼンの濃度が高くなっています。なぜなら、ベンゼンの蒸気圧の方がトルエンより大きいからです。 これが、混合物の蒸気圧、すなわち、気液平衡です。 気液平衡とは、気相と液相とが平衡(つり合う)にあるという意味ですが、これは、図7にあるように、気相の濃度と液相の濃度がつり合っているという意味なのです。 |
|||||||||||||||||||||||
 |
|||||||||||||||||||||||
|
図7 気相はベンゼンの濃い蒸気が得られる (気体のことを気相、液体のことを 液相と言います) →「気液平衡」 |
|||||||||||||||||||||||
| 1回の蒸発で得られた気相を、凝縮して、また蒸発させますと、さら にベンゼンの濃度が高いベンゼンとトルエンの混合物の気相を得ることができます。この蒸発、凝縮、蒸発・・・という繰り返しが蒸留の原理となります。
蒸留を実現するためには、蒸留する溶液の気液平衡が必要不可欠です。ここに、気液平衡を学ぶ意味があるのです。 気液平衡の計算例を以下に示します。 |
|||||||||||||||||||||||
| 【気液平衡の計算例】 | |||||||||||||||||||||||
|
ベンゼンとトルエンが等モル存在するときの気液平衡を計算します。 液相のベンゼンおよびトルエンのモル分率は、それぞれ0.5となります。 今、40℃の場合を考えますと ベンゼンの蒸気圧の測定値は25.0 kPa, トルエンの蒸気圧の測定値は7.89 kPaですから、ラウールの法則により ベンゼンの気相における分圧は、25.0×0.5=12.5(kPa) トルエンの気相における分圧は、7.89×0.5= 4.0(kPa) ベンゼンの気相におけるモル分率は、12.5÷16.5=0.76(モル分率) トルエンの気相におけるモル分率は、4.0÷16.5=0.24(モル分率) がえられます。 すなわち、液相にはベンゼンとトルエンは1対1で存在しているのに、 気相ではベンゼンとトルエンは約3対1で存在しているのです。 図7は、この液相と気相の濃度の関係を、模式的に示しています。 |
|||||||||||||||||||||||
| (ご注意)本著作は著作権法で保護されています。本解説には、本解説でしか使われていないものが含まれています。本著作を引用する場合は、必ず「東京理科大学 元教授 大江修造によれば」と明記してください。 |
|||||||||||||||||||||||
| 3.気液平衡の計算方法 | |||||||||||||||||||||||
|
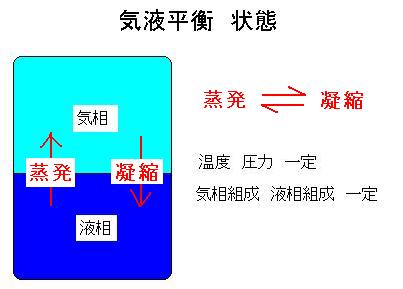
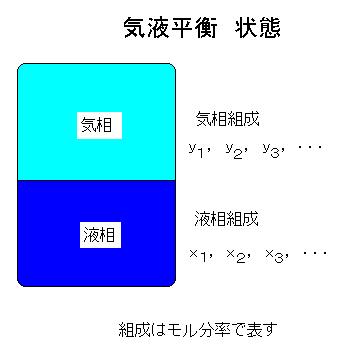
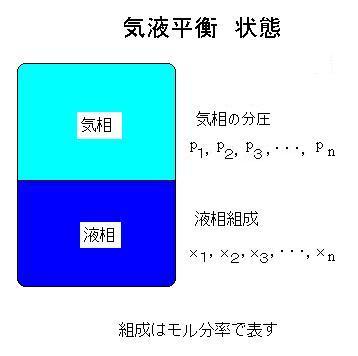
蒸留塔の設計には気液平衡の計算が必要です.この気液平衡を原理図により分かりやすく解説します。密閉した容器中に溶液を入れた状態で、温度、圧力、気相と液相の各組成が変わらない状態を気液平衡状態と言います。図を参照してください. これは液相から気相への蒸発と気相から液相への凝縮とが平衡になった状態です.蒸発・凝縮の際,通常の気液平衡では成分同士は反応しません.反応をする場合は「反応を伴う気液平衡」と言って区別します.揮発成分同士の気液間の平衡を気液平衡と言い,固体成分を含む平衡(蒸気圧降下や沸点上昇)は気液平衡とは言わずに固液平衡と言います. 温度、圧力、気相と液相間の関係を図で示すのが気液平衡曲線あるいは相図と言います.また気相と液相間の関係を図で示すのがx-y曲線で,主に化学工学で使います.参考:気液平衡データ 気液平衡の計算はラウールの法則や活量係数を用いて行います.ラウールの法則を用いることができる理想溶液の場合は蒸気圧データのみから計算すなわち推算できます.活量係数を用いる非理想溶液の場合は実験により得たデータから相関します. |
|||||||||||||||||||||||
 |
|||||||||||||||||||||||
| 気液平衡の計算方法は種々あり、大別すると次の5種になります。 | |||||||||||||||||||||||
| 気液平衡の計算(1) | |||||||||||||||||||||||
 |
|||||||||||||||||||||||
|
y2=K2x2 y3=K3x3 ..... yn=Knxn ここに, K1,K2,K3,....Knを平衡係数あるいは平衡比と言います。1,2,3,....,nはそれぞれ第1成分,第1成分,第2成分,第3成分,,..,第n成分を示します。 |
|||||||||||||||||||||||
| 気液平衡の計算(2) | |||||||||||||||||||||||
|
y2=α2x2/(α1x1+α2x2+α3x3+...+αnxn) y3=α3x3/(α1x1+α2x2+α3x3+...+αnxn) ..... ここに, α1,α2,α3,....を相対揮発度と言い、 それぞれ,P1/Pn,P2/Pn,P3/Pn,....,Pn/Pnであり、P1,P2,P3,..,Pnは、それぞれ各成分が単独で存在するときの蒸気圧です。 |
|||||||||||||||||||||||
| 気液平衡の計算(3) | |||||||||||||||||||||||
 |
|||||||||||||||||||||||
|
ラウールの法則による計算 p2=P2x2 p3=P3x3 ..... pn=Pnxn ここに, p1,p2,p3,....,pnを各成分の分圧と言います。 P1,P2,P3,..,Pnは、それぞれ各成分が単独で存在するときの蒸気圧です。このように気液平衡を表現できるのは理想溶液の場合です。蒸気圧はアントワン式により計算します. |
|||||||||||||||||||||||
| 気液平衡の計算(4) | |||||||||||||||||||||||
|
p1=P1γ1x1 p2=P2γ2x2 p3=P3γ3x3 ..... pn=Pnγnxn ここに,P1,P2,P3,..,Pnは、それぞれ各成分が単独で存在するときの蒸気圧である。p1,p2,p3,....,pnを各成分の分圧と言います。γ1,γ2,γ3,....,γnをそれぞれ各成分の活量係数と言い、非理想溶液の気液平衡を表現するための熱力学的に定義される係数です。ラウールの法則を活量係数で補正した表現です.活量係数はウィルソン式により計算します. |
|||||||||||||||||||||||
| 気液平衡の計算(5) | |||||||||||||||||||||||
| 成分の1つが臨界温度を超える温度ではラウールの法則などでは表現できません.このような場合は状態方程式を使います. | |||||||||||||||||||||||
|
|||||||||||||||||||||||
|

